Электролиты — вещества, расплавы или растворы которых могут проводить электрический ток.
Неэлектролиты — вещества, расплавы или растворы которых не могут проводить электрический ток.
Диссоциация и степень диссоциации
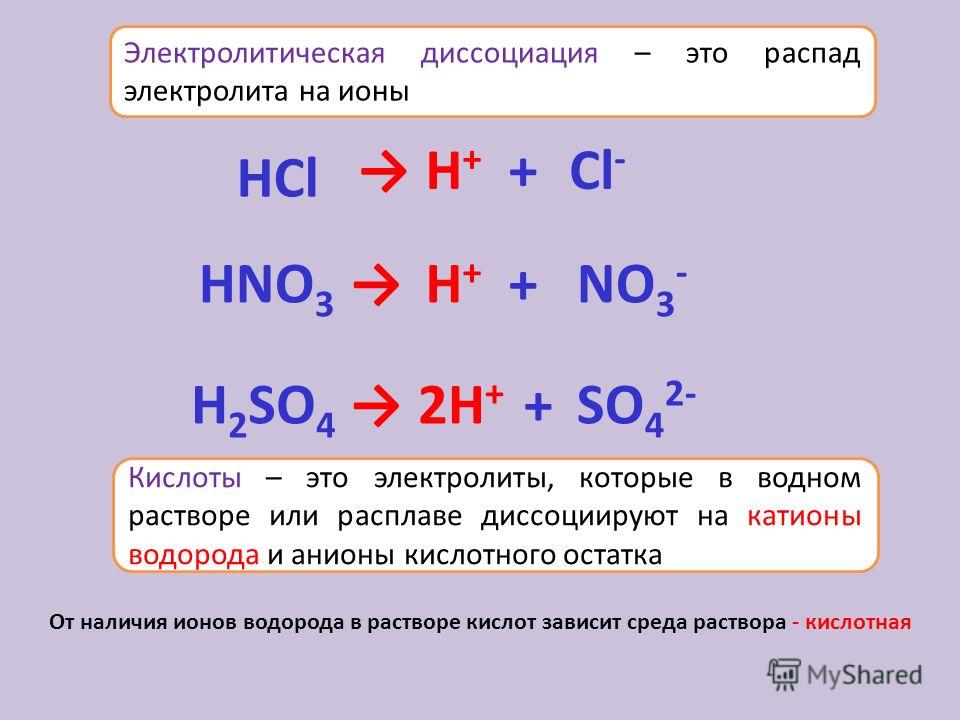
Диссоциация — это распад соединений на ионы.
Степень диссоциации (α) — это отношения числа продиссоциировавших, то есть распавшихся на ионы молекул к их общему числу растворенных молекул.
Формула:
- α = n/N
Стрелкой → обозначают распад соединений на ионы.
Стрелкой ← обозначают обратный процесс.
Сильные электролиты
Сильные электролиты — это вещества, которые при растворении в воде почти полностью диссоциируют на ионы.
Поэтому в уравнениях диссоциации ставят знак равенства (=) для сильных электролитов.
К сильным электролитам относятся:
- Многие неорганические кислоты, такие как: H2SO4, HNO3, HClO3, HMnO4, HClO4, HBr, HCl, HI.
- Основания щелочноземельных (Ca(OH)2, Ba(OH)2, Sr(OH)2) и щелочных (KOH, NaOH, LiOH) металлов.
- Растворимые соли.
Слабые электролиты
Слабые электролиты — это такие вещества, которые только частично диссоциируют на ионы.
Поэтому в уравнениях диссоциации ставят знак обратимости (⇄) для слабых электролитов.
К слабым электролитам относятся:
- Вода и практически все органические кислоты.
- Некоторые неорганические кислоты: H3PO4, H2SiO3, H2S, H3PO4, HNO2, H2CO3.
- Нерастворимые гидроксиды металлов: Zn(OH)2, Mg(OH)2, Fe(OH)2.
Сильные и слабые электролиты
Как различить сильные и слабые электролиты? Сильные электролиты в растворах почти полностью диссоциированы. К данной группе в большой степени относятся соли, сильные кислоты и щелочи. Слабые электролиты включают слабые основания и кислоты, а также некоторые соли, цианид ртути (II), хлорид ртути (II), иодид кадмия и роданид железа (II).









Новые комментарии